过去,医学界普遍推测他汀引起的肌病可能与辅酶Q10合成受阻、线粒体功能受损有关,但始终缺乏确凿证据。如今,一项发表于国际顶级期刊《Nature Communications》的重磅研究,终于从分子层面揭开了他汀致肌病的“黑箱”——原来,罪魁祸首是他汀分子在肌肉细胞里“组团作案”,强行撬开了钙离子的“闸门”。

一、肌肉疼痛的根源:钙离子“失控”了
在我们的骨骼肌细胞中,有一种关键的蛋白质受体,名叫兰尼碱受体1(RyR1)。它就像一个精密的“闸门”,负责调控细胞内钙离子的释放。正常情况下,只有当肌肉需要收缩时,这个闸门才会短暂打开,释放适量钙离子;收缩完成后,闸门迅速关闭,维持细胞内钙稳态。
一旦这个闸门“关不严”,钙离子就会持续外漏,导致细胞内钙浓度异常升高。这不仅会引发肌肉不自主收缩、痉挛,还会激活一系列破坏性酶反应,最终造成肌肉损伤,表现为疼痛、乏力,严重时甚至导致横纹肌溶解——一种可能危及生命的急症。
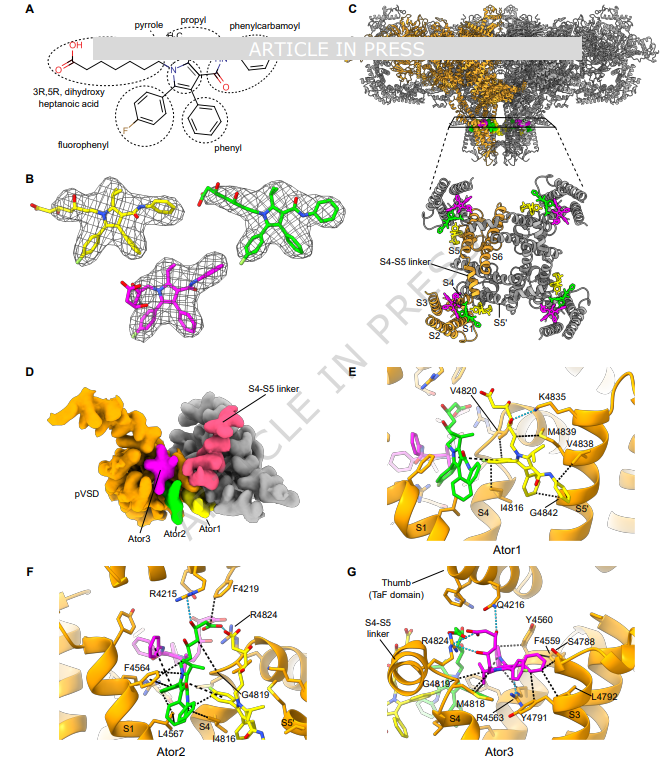
二、他汀如何“撬开”钙闸门?三分子联手作案!
这项由Molinarolo、Valdivia等学者领衔的新研究,借助冷冻电子显微镜(cryo-EM)技术,首次在接近原子级的分辨率下观察到:阿托伐他汀(常用他汀之一)并非单独行动,而是以三个分子为一组(研究者称之为“他汀三联体”)精准攻击兰尼碱受体。
具体过程如下:
- 第一个他汀分子悄悄附着:在钙通道处于关闭状态时,一个阿托伐他汀分子率先“潜入”受体蛋白的一个特定“口袋”,就像在门轴上塞进一颗小石子,让闸门变得松动。
这一机制解释了为何即使肌酸激酶(CK)水平未明显升高,患者仍会出现明显的肌肉不适——因为问题出在细胞信号层面,而非大规模肌肉坏死。
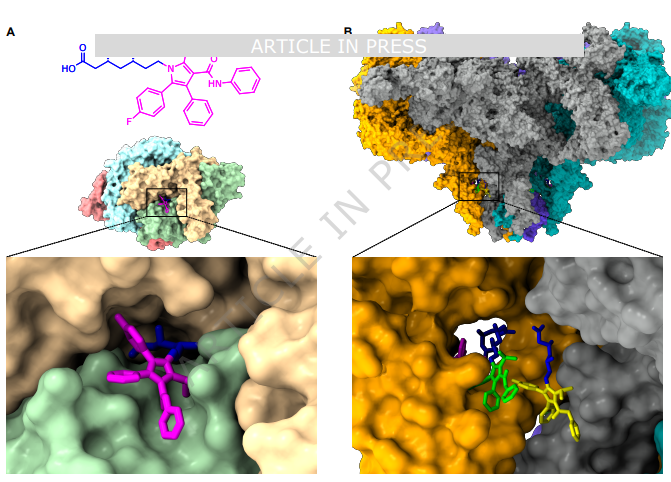
三、并非所有他汀都“危险”:关键看化学结构
研究进一步发现,能否形成这种致病性“三联体”,取决于他汀分子是否含有“氟苯基”结构。
- 含氟苯基、易形成三联体的他汀包括:
- 阿托伐他汀(亲脂性,常用)
- 氟伐他汀(亲脂性,临床仍在用)
- 瑞舒伐他汀(亲水性,常用)
- 西立伐他汀(因严重肌毒性已退市)
- 不含氟苯基、不易触发该机制的他汀则包括:
- 辛伐他汀
- 普伐他汀
四、为何有人特别“敏感”?基因可能是关键
研究还指出,部分人群对他汀肌病异常敏感,可能与其遗传背景有关。例如,携带恶性高热易感基因(如RYR1突变)的人,其兰尼碱受体本身“关门”功能就存在缺陷。一旦遭遇他汀三联体的“撬门”作用,钙泄漏风险成倍增加,更容易出现严重肌肉反应。
这为未来个体化用药提供了重要线索:通过基因筛查,可提前识别高风险人群,选择更安全的他汀类型或替代方案。
五、未来可期:新一代“无肌毒”他汀正在路上
这项突破性研究不仅解释了长期悬而未决的临床难题,更为药物研发指明了方向:若在新药设计中去除氟苯基结构,并优化分子疏水尾部,有望开发出不干扰钙通道、无肌肉毒性的新一代他汀。
对于正在服用他汀的朋友,也不必恐慌。他汀的整体获益远大于风险,关键在于科学选择、合理监测、个体化用药。若出现不明原因的肌肉酸痛、无力,应及时就医,检测肌酸激酶,并与医生共同评估是否调整药物。
参考文献: Molinarolo, S., Valdivia, C.R., Valdivia, H.H. et al. Cryo-electron microscopy reveals sequential binding and activation of Ryanodine Receptors by statin triplets. Nat Commun (2025).



 微信扫一扫打赏
微信扫一扫打赏 支付宝扫一扫打赏
支付宝扫一扫打赏



评论列表()